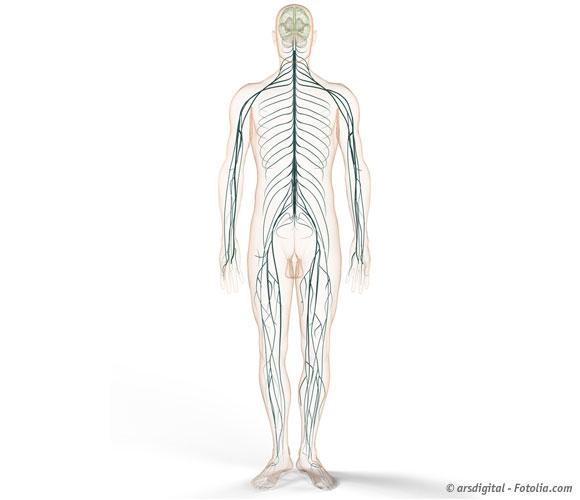
Ein Nerv (vom Lateinischen: Nervus) ist eine anatomische Struktur, die der Erregungsleitung dient. Er besteht aus zahlreichen gebündelten Nervenfasern, die von Bindegewebe umgeben sind. Nervenzellen (Neuronen) bestehen aus ihrem Zellkörper (Soma) und dessen Fortsätzen (Axon).
Funktionell lassen sich Nervenstränge in motorische Nerven, also solche, die Bewegungsabläufe steuern und sensorische Nerven, die für die Weiterleitung von Sinnenseindrücken zuständig sind, unterscheiden. Hier gibt es auch Mischfunktionen.
Die Gesamtheit der Nervenstränge mit ihren verschiedenen Aufgaben und Funktionen wird als Nervensystem bezeichnet. Dieses lässt sich einerseits nach funktionellen Gesichtspunkten unterscheiden:
- somatisches (willkürliches) Nervensystem: Dies ist jener aktiv beeinflussbare Teil des Nervensystems, der die Bewegungen (Motorik) der Muskulatur steuert;
- autonomes (vegetatives, unwillkürliches) Nervensystem: Dieser Teil des Nervensystems steuert essentiell lebensnotwendige Körperfunktionen wie Atmung, Stoffwechselvorgänge und Verdauung. Das autonome Nervensystem entzieht sich in seiner Funktion weitgehend der willentlichen Kontrolle durch das Gehirn.
Außerdem wird das Nervensystem nach räumlichen (topographischen) Aspekten unterschieden:
- zentrales Nervensystem (ZNS): Die sind die dem Gehirn und Rückenmark entspringenden Nervenstränge. Sie dienen etwa der Verarbeitung der aus der Peripherie ankommenden sensorischen Reize. Hier wird auch die willkürliche Bewegungssteuerung (Motorik) ausgelöst. Auch am bewussten und unbewussten Denken ist das ZNS wesentlich beteiligt.
- Peripheres Nervensystem (PNS): Dies ist der Teil des Nervensystems, der sich außerhalb von Gehirn und Rückenmark befindet. Es verbindet das ZNS mit den „ausführenden“ Organen.Die Abgrenzung zwischen ZNS und PNS dient allein der räumlichen Unterscheidung, in ihrer Funktionalität sind beide miteinander verwoben. So finden sich bei den motorischen Nerven die Nervenzellen mit ihrem Zellkörper im ZNS, während sich ihr Nervenzellfortsatz (Axon) im PNS befindet. Umgekehrt befindet sich bei den sensorischen Nerven ihr Zellkörper zumeist im PNS, während der Fortsatz in das ZNS führt.
Alzheimer – Demenz
Zum Einstieg ist sicher eine Begriffsklärung sinnvoll, da in unserem täglichen Sprachgebrauch viele verschiedene Termini nebeneinander verwendet werden, die zum Teil ein und dasselbe Phänomen beschreiben, zum Teil aber auch gänzlich falsch sind. Also: Der Begriff „Alzheimer“ oder „Alzheimersche Krankheit“ meint die häufigste, aber nicht die einzig mögliche Form von so genannten neurodegenerativen Erkrankungen, die durch den fortschreitenden Abbau von Nervenzellen (Neurodegeneration) des Gehirns gekennzeichnet sind. Dies führt irgendwann zu einem ausgeprägten Defizit an kognitiven (vom lat. cognoscere = ,kennen, lernen, wiedererkennen), emotionalen und sozialen Fähigkeiten mit Beeinträchtigung von sozialen und beruflichen Kompetenzen (Persönlichkeitsveränderung). Dieser Defizitzustand wird als Demenz bezeichnet: Der Begriff Demenz ist also nicht die Bezeichnung für die Erkrankung an sich, sondern er beschreibt den krankheitsbedingten Status verminderter geistiger Leistungsfähigkeit.
Medizinisch korrekt ist immer noch die Bezeichnung Alzheimer-Krankheit oder Morbus Alzheimer, benannt nach dem deutschen Psychiater und Neuropathologen Alois Alzheimer (1864-1915), der die typischen geistigen Defizitsymptome bei einer noch relativ jungen Patientin 1901 erstmals beschrieb und nach deren Tod 1906 das Gehirn sezierte, wobei er deutlich sichtbare Veränderungen in der Hirnstruktur feststellte: Eiweißablagerungen, verfilzte Nervenbündel und abgestorbene Areale. Er bezeichnete dies damals noch vage als „eine eigenartige Krankheit der Hirnrinde“.
Weltweit sind etwa zwei Drittel aller Demenzerkrankungen solche vom Typ Alzheimer, in Deutschland sind gegenwärtig etwa 1,2 Millionen Fälle bekannt; wegen der weiter steigenden Lebenserwartung wird bis 2050 mit einer Verdoppelung der Fallzahlen gerechnet, denn die Alzheimer-Krankheit ist ein typischen Altersleiden, wenngleich -selten- auch Personen unterhalb des 50. Lebensjahres betroffen sind.
Heute weiß die medizinische Forschung zwar ziemlich genau, wie die degenerativen Prozesse, welche zur Demenz vom Typ Alzheimer führen, ablaufen; indes ist bisher nicht genau geklärt, welche Ursachen das Zellsterben im Gehirn auslösen. Sicher ist, dass es eine Reihe von Risikofaktoren gibt, die das Entstehen der Erkrankung begünstigen können. Dies sind neben einer familiären Komponente (ein erblicher Gendefekt, auf den man sich testen lassen kann) Faktoren wie Übergewicht, Tabak- und Alkoholkonsum, Bluthochdruck, Diabetes mellitus, ein dauerhaft erhöhter Cholesterinspiegel, Funktionsstörungen der Schilddrüse sowie Arteriosklerose. Ein wesentlicher Risikofaktor ist, auch wenn dies böse klingt, das Lebensalter: Jenseits des 60. Lebensjahres steigt das Risiko, an Alzheimer zu erkranken, immer steiler an. Von den über 80-jährigen zeigen bereits etwa 20 Prozent Symptome der Krankheit, wobei insgesamt Frauen etwas häufiger als Männer betroffen sind.
Der Mediziner unterscheidet verschiedene Stadien der Erkrankung mit jeweils typischen Symptomen, die von leichter Vergesslichkeit im Frühstadium bis zur Bettlägerigkeit mit Totalverlust der geistigen und auch motorischen Fähigkeiten reichen. Die Diagnose „Alzheimer“ ist nicht leicht zu stellen; sie ist eine so genannte Ausschlussdiagnose, also das, was übrig bleibt, wenn verschiedene andere Erkrankungen, die ebenfalls dementielle Symptome hervorrufen, ausgeschlossen werden können. Solche Erkrankungen sind etwa die normale altersbedingte Vergesslichkeit (leichte kognitive Störung, LKS), psychische Störungen wie etwa Depressionen, Psychosen, Wahn, organische Gehirnerkrankungen wie Tumore oder Durchblutungsstörungen (etwa nach einem Schlaganfall) oder Stoffwechselstörungen.
Hieraus ergibt sich, dass eine ganze Reihe von Untersuchungen erforderlich ist, um zur richtigen Diagnose zu gelangen wenn man den Eindruck hat, bei sich selbst oder beim Partner bzw. Freunden könnte geistig etwas nicht (mehr) stimmen. Der richtige Ansprechpartner ist der Facharzt für Neurologie: Er lässt sich zunächst die Symptome schildern und wird dann eine Reihe von neuropsychologischen Tests durchführen, womit Art und Schweregrad der Gedächtnisstörungen aufgedeckt werden können. Blutuntersuchungen sowie Untersuchung des Gehirns mit bildgebenden Verfahren (MRT, CT) dienen in erster Linie dazu, mögliche andere Erkrankungen ausschließen zu können; im Frühstadium der Erkrankung sind nämlich beim Betroffenen meist noch keine degenerativen Veränderungen der Hirnsubstanz erkennbar.
Trotz immensem Forschungsaufwand ist die Alzheimer-Krankheit bisher nicht heilbar; somit zielen alle möglichen Behandlungswege darauf ab, die Symptome zu lindern und das Fortschreiten der Erkrankung zu verlangsamen. Hierzu kommt eine Reihe von Medikamenten zum Einsatz, begleitet von psycho- und soziotherapeutischen Behandlungen wie Ergotherapie, Logopädie und Physiotherapie. Welcher Behandlungsmix in Frage kommt, muss für jeden Einzelfall festgelegt, überwacht und ggfs. modifiziert werden.
Neben den derzeit anerkannten Behandlungswegen laufen weitweit klinische Studien zur Erprobung neuer Medikamente und Verfahren (z.B. Entwicklung und Erprobung eines wirksamen Impfstoffs). Dies auch nur ansatzweise aufzulisten würde den Rahmen dieser Beschreibung sprengen. Ein Blick ins Internet gibt einen ersten Eindruck der Fülle an möglichen Chancen und auch falschen Versprechungen. Wichtig ist, sich als Betroffener oder Angehöriger nicht nur mit der Meinung und Kenntnis eines einzelnen Arztes zufrieden zu geben, sondern immer wieder gezielt nach neuen Behandlungsmöglichkeiten zu fragen und zu suchen. Wer sich sagt: „Was habe ich schon zu verlieren?“ kann sich auch um die Teilnahme an klinischen Studien bemühen, wo neuartige Medikationen auf ihre Wirksamkeit getestet werden. Einen gut verständlichen Einstieg in die Materie bietet etwa die Internetplattform www.alzheimer-forschung.de .
Text: Alexander Strauch
Epilepsie
Die genauen Zusammenhänge, die letztlich zum Auftreten epileptischer Anfälle führen, sind noch nicht vollständig bekannt. Sicher ist aber, dass beim Krankheitsbild der Epilepsie einerseits eine Übererregbarkeit (Hyperexzitabilität) von Nervenzellen und andererseits eine abnormale gleichzeitige elektrische Aktivität von größeren Nervenzellverbänden (so genannte neuronale Netze) besteht. Die gängige These ist, dass ein Ungleichgewicht von Erregung und Hemmung in diesen neuronalen Netzen die Krampfanfälle entstehen lässt.
In der medizinischen Praxis wird zwischen symptomatischen Epilepsien (als Folge einer Hirnschädigung, Fehlbildung des Gehirns oder einer anderen Grunderkrankung, beispielsweise Stoffwechselstörungen oder Hirntumore) und idiopathischen Epilepsien, also Erkrankungen ohne feststellbare Ursache unterschieden. Für die letztgenannte Form lässt sich aber in vielen Fällen eine genetische Veranlagung diagnostizieren.
Eine weitere Unterscheidung wird hinsichtlich des Ursprungs und Umfangs der neuronalen Entladungen gemacht: Der Mediziner spricht von begrenzten (fokalen) und generalisierten Anfällen. Der fokale Anfall hat seinen Ursprung in einer bestimmten (begrenzten) Hirnregion und in der Mehrzahl der Fälle eine weniger schwere Symptomatik: Kribbeln und Taubheitsgefühl in den Gliedmaßen, Schmerzen, Seh- und Hörstörungen, Übelkeit, Schweißausbrüche, zumeist kein Bewusstseinsverlust. Sind hingegen weite Hirnregionen von neuronalen Entladungen betroffen, liegt ein generalisierter Anfall mit Sturz, schweren Muskelkrämpfen und Zuckungen, Bewusstlosigkeit mit Gedächtnnisverlust dieser Phase, unkontrolliertem Urinabgang und Biss in die Zunge vor.
Um eine Epilepsie zu diagnostizieren und deren Art und Genese richtig einordnen zu können, sind mehrere Untersuchungsverfahren erforderlich. Wichtig ist zunächst, die beim Anfall auftretenden Symptome in ihrer Art, Schwere und Reihenfolge genau zu beschreiben. Da der Betroffene selbst hierzu wegen der zeitweisen Bewusstlosigkeit nicht oder nur begrenzt in der Lage ist, muss dies von Dritten, die den Anfall in Gänze beobachten konnten, geleistet werden. Manche Patienten können typische Vorauszeichen (Aura) eines kommenden Anfalls benennen, wie Kribbeln oder ein aufsteigendes Unwohlsein aus der Magengegend. Das Gehirn wird mit den modernen bildgebenden Verfahren (MRT, ggfs. CT) gescannt, um krankhafte Veränderungen zu erkennen. Ergänzt wird dies, wenn erforderlich, durch die Angiographie (Darstellung von Blutgefäßen im Röntgenbild mittels Kontrastmittel) sowie durch die Hirnstrommessung (Elektroenzephalographie, EEG), mit der die krankhaften Entladungen von Nervenzellen des Gehirns direkt gemessen, lokalisiert und dokumentiert werden können, auch über längere Zeiträume (24 h).
Bei der Behandlung von Epilepsie ist zu unterscheiden zwischen Sofortmaßnahmen bei einem akuten Anfall und vorbeugenden Maßnahmen (Anfallsprophylaxe), um möglichst eine völlige Anfallsfreiheit bei geringsten Nebenwirkungen zu erreichen. Da ein Anfall üblicherweise binnen weniger Minuten vorbei ist, geht es bei der Soforthilfe darum, den Betroffenen vor Stürzen oder gefährlichen Gegenständen / Möbelkanten in seiner Nähe zu schützen, beengende Kleidung zu lockern und die Atemwege frei zu halten (ggfs. Zahnprothese oder Erbrochenes entfernen). Ist der Betroffene nach wenigen Minuten wieder bei Bewusstsein, sollte man beruhigend auf ihn einwirken, etwaige Verletzungen versorgen und ggfs. auch an eine Decke gegen Unterkühlung denken. Wenn ein epileptischer Anfall allerdings länger als fünf Minuten dauert und / oder der Betroffene das Bewusstsein nicht wieder erlangt bzw. weiter verwirrt bleibt ist dies ein Notfall (Status epilepticus), der intensivmedizinisch behandelt werden muss – Notarzt rufen!
Ergeben die Untersuchungen, dass mit wiederholten Anfällen zu rechnen ist, wird eine medikamentöse Therapie zur Vorbeugung eingeleitet: Bewährte Wirkstoffe sind hier etwa Carbamazepin, Clonazepam oder Valproinsäure, die u.a. die Erregbarkeit der betroffenen Nervenregionen herabsetzen. Bei günstigem Verlauf (normalisiertes EEG, Anfallsfreiheit) besteht die Möglichkeit, die medikamentöse Therapie nach einigen Jahren ausschleichend zu beenden. In bestimmten, schweren Fällen von fokalen (begrenzten) Epilepsien kommt nach Ausschöpfung aller pharmazeutischen Optionen auch ein chirurgischer Eingriff in Betracht, wobei das anfallauslösende Hirnareal (wenige Millimeter) entfernt wird. Dies ist mit zahlreichen Risiken verbunden und muss daher für jeden Einzelfall vorher genau geprüft und abgewogen werden. Ferner besteht die Möglichkeit der elektrischen Stimulation des Vagusnervs mittels eines implantierten Stimulators, der vom Betroffenen bei Vorgefühl eines Anfalls selbst aktiviert werden kann.
Text: Alexander Strauch
Multiple Sklerose (MS)
Was passiert nun bei jener Fehlsteuerung von Körperfunktionen, die als Multiple Sklerose bezeichnet wird? MS zählt, wie auch Erkrankungen des rheumatischen Komplexes, zu den so genannten Autoimmunerkrankungen, bei denen die Abwehrzellen des Immunsystems sich gegen den gesunden Organismus richten. Beim Krankheitsbild MS greifen derartige Antikörper das Zentralnervensystem im Gehirn und Rückenmark an. Warum dieser zerstörerische Prozess in Gang kommt, ist noch nicht abschließend geklärt; möglicherweise kam es bei den Betroffenen in der Vergangenheit zu einer Infektion mit Erregern, deren Struktur teilweise mit körpereigenen Strukturen identisch ist. Ein erblicher Faktor ist ebenso von Bedeutung: Direkte Verwandte von MS-Patienten haben ein, verglichen mit der Gesamtbevölkerung, um den Faktor 10 bis 30 erhöhtes Risiko, ebenfalls zu erkranken. Auch hartnäckige bzw. lebenslang bestehende Infektionen mit bestimmten Herpesviren oder Chlamydien stehen im Verdacht, die Entstehung von MS zu begünstigen.
Die durch das fehlgesteuerte Immunsystem ausgelösten Entzündungsvorgänge im Gehirn und Rückenmark führen zu einer Zerstörung bestimmter Bereiche in der Umhüllung (Markscheiden) der Nervenfasern und speziellen Fortsätzen, den Oligodendrozyten. Das zerfallende Gewebe der Markscheiden wird durch Neubildung von hartem Narbengewebe ersetzt (Sklerosierung) – mit der Folge, dass irgendwann die Reizweiterleitung von einer Nervenzelle zur korrespondierenden Muskelzelle, aber auch zu anderen Arten von Körperzellen, entweder gar nicht mehr oder nur noch eingeschränkt funktioniert. Üblicherweise verläuft die Krankheit über Jahrzehnte schubweise, mit tendenzieller Verschlimmerung von Schub zu Schub, aber auch Verlaufsformen mit kontinuierlicher Verschlechterung des Befindens sind möglich.
Die spürbaren Folgen bzw. Symptome dieser degenerativen Vorgänge sind zunehmende Störungen der Bewegungsfähigkeit des Körpers (Motorik), der Sinne und Wahrnehmung (Sensorik) und weiterer Körperfunktionen. Typisch sind etwa Sehstörungen, Taubheitsgefühle in den Gliedmaßen und Muskelschwäche bis hin zu Lähmungserscheinungen und Muskelversteifungen (Spasmen). Insgesamt ist die Symptomatik aber so dermaßen vielgestaltig und teilweise unspezifisch („Krankheit der 1.000 Gesichter“), dass die Diagnose nicht einfach zu stellen ist, sondern es hierzu stets eine Kombination verschiedener Untersuchungsverfahren bedarf. Am Besten lassen sich diese Untersuchungen stationär in spezialisierten Behandlungszentren durchführen, also alles zeitnah am gleichen Ort und mit ausführlicher Aufklärung und Beratung. Nach der Befragung zu Vorgeschichte und akuten Beschwerden (Anamnese) werden neurologische Tests durchgeführt (Untersuchung des Seh- und Gehvermögens sowie von Koordinations- und Konzentrationsfähigkeit). Eine Punktion des Rückenmarks mit labordiagnostischer Untersuchung der Flüssigkeit ist ebenso Standard wie die Kernspintomografie (MRT) des Gehirns, wo sich ggfs. charakteristische Veränderungen zeigen können. Schließlich erfolgt eine Untersuchung der Hirnströme (EEG) unter Anwendung äußerer Nervenreizungen, so genannter evozierter Potentiale, um eine Verlangsamung der Reizweiterleitung aufdecken zu können.
Da eine ursächliche Heilung der MS immer noch nicht möglich ist, zielen alle Therapievarianten darauf ab, die Häufigkeit und Schwere von Krankheitsschüben zu verringern. Es geht also bei der Schubtherapie um die symptomatische Behandlung eines akuten Entzündungsschubes, zumeist durch eine hoch dosierte Kortisongabe, zunächst einige Tage als Injektion, dann ausschleichend noch etwa 10 Tage in Tablettenform. Durch diese kurzzeitige Anwendung sind die bekannten Nebenwirkungen und Schädigungen einer Kortison-Langzeittherapie nicht oder nur in geringerem Umfang zu befürchten. Bei Unverträglichkeit oder Nichtansprechen auf die Kortisontherapie besteht die Möglichkeit der Plasmapherese, also einer stationär durchgeführten Art Blutwäsche, bei der das antikörperbelastete Blutplasma herausgefiltert und ersetzt wird.
Neben dieser Akutbehandlung kommt eine Basistherapie (Langzeittherapie) zur Anwendung, die den weiteren Krankheitsverlauf günstig beeinflussen soll. Die Wirkstoffe, die hierbei verabreicht werden sind etwa Interferone (künstliche Eiweiße, die Immunreaktionen verringern können), außerdem der Wirkstoff Glatirameracetat, welcher zumeist die Häufigkeit von Entzündungsschüben senkt. Neue Wirkstoffe sind Natalizumab und das noch in der klinischen Erprobung befindliche Fingolimod: Der erstgenannte Stoff bewirkt, dass die aggressiven Antikörper erst gar nicht ins Nervensystem gelangen können; Fingolimod hingegen „fixiert“ schädliche Abwehrzellen in den Lymphknoten.
Die symptomatische Begleittherapie schließlich beinhaltet Maßnahmen wie Physiotherapie zur Besserung von Gehbehinderungen und Koordinationsstörungen. Ferner können eine gesunde Lebensweise mit Verringerung von Stresssituationen, großen körperlichen Anstrengungen und Vermeidung von Hitze den Krankheitsverlauf günstig beeinflussen. Insgesamt ist der Krankheitsverlauf oft weniger schwerwiegend, wie gemeinhin von Nichtinformierten vermutet wird: Man kann sich jahrzehntelang mit MS arrangieren, wenn die Erkrankung so früh wie möglich erkannt und konsequent behandelt wird.
Text: Alexander Strauch
Trigenimusneuralgie
Insgesamt ist das Trigenimusleiden keine häufige Erkrankung, weltweit sind etwa fünf von 100.000 Menschen betroffen, Frauen etwas häufiger als Männer. In der medizinischen Praxis werden zwei Formen der Erkrankung unterschieden: Die klassische (idiopathische) Trigenimusneuralgie ist die häufigere Form, hier lässt sich entweder gar keine organische Ursache finden oder als Auslöser wird ein Kontakt zwischen einem benachbarten Blutgefäß (pulsierende Arterie) und dem Nervenstrang ermittelt, wodurch dieser gereizt und geschädigt wird. Ein solcher Kontakt kann etwa durch Versteifung und Vergrößerung infolge Arterienverkalkung (Arteriosklerose) einer Ader entstehen, die im gesunden Zustand niemals gestört hat. Bei der selteneren symptomatischen Form ist der Nervenstrang infolge einer anderen Grunderkrankung, etwa bei Multipler Sklerose, durch Tumorwachstum oder als postherpetische Neuralgie nach Herpes Zoster (Gürtelrose) im Gesichtsbereich, geschädigt. In etwa der Hälfte aller Fälle betreffen die Schmerzen den zweiten, mittleren Trigenimusast (Wange und Oberkiefer), etwa 30 Prozent entfallen auf den unteren Ast (Unterkiefer) und 20 Prozent auf beide Äste gleichzeitig. Eine Beteiligung des ersten, oberen Astes (Stirn, Auge) tritt nur sehr selten auf.
Typischerweise beginnt die Erkrankung im höheren Lebensalter jenseits von 40 Jahren. Ein weiteres Merkmal einer Trigenimusneuralgie ist die Tatsache, dass die gefürchteten Schmerzattacken auch durch normale Muskelbewegungen im Kopfbereich wie Kauen und Schlucken, Sprechen und Lachen oder Kieferbewegungen beim Zähneputzen ausgelöst (getriggert) werden können, ebenso durch bloße Berührung des Wangenbereichs oder kalte (Zug-) Luft. Viele Betroffene entwickeln daher ein ausgeprägtes Vermeidungsverhalten bzw. sind suizidgefährdet.
Zur Diagnose der Krankheit -wie auch zur Begleitung der Therapie- sollte man sich an ein spezialisiertes Behandlungszentrum wenden. Nach Befragung zu Art, Häufigkeit, Verlauf und Lokalisierung der Schmerzen wird i.d.R. eine MRT („Kernspin“)-Aufnahme des Kopfes angefertigt, mit der der Verlauf der Trigenimusäste gut darstellbar ist. Hiermit lassen sich auch andere Grunderkrankungen als Ursache feststellen oder ausschließen.
Da eine akute Schmerzattacke nur Sekunden dauert, ist eine Akuttherapie mit herkömmlichen Schmerzmitteln nicht wirksam. Daher kommen zur wirksamen medikamentösen Behandlung zumeist Substanzen aus der Gruppe der so genannten Antikonvulsiva wie Carbamazepin, Lamotrigen oder Oxcarbazepin zur Anwendung. Die Substanzen setzen die Erregbarkeit der Nervenstränge herab. Hier muss für jeden Einzelfall die Kombination mit bestmöglicher Wirksamkeit ermittelt werden.
Zeigt die medikamentöse Therapie keine ausreichende Wirksamkeit, kommen auch verschiedene Operationsverfahren in Frage, bei der entweder Blutgefäße in Nachbarschaft des Nervs verödet werden oder direkt Nervenfasern im Bereich der Verzweigung (Ganglion Gasseri) zerstört werden. Relativ neu ist die radiologische Behandlung des Nervs mit einem so genannten Gamma-knife, die oft eine beachtliche Sofortbesserung bringt aber bisher nicht dauerhaft attackenfrei macht. Zu den nicht unerheblichen Risiken der operativen Eingriffe ( wie möglicher einseitiger Hörverlust, Taubheitsgefühle oder Dauerschmerzzustände) muss man sich als Betroffener unbedingt ausführlich beraten lassen und dann mit dem Arzt des Vertrauens abwägen, welche Vorgehensweise im konkreten Fall den besten Erfolg verspricht.
Text: Alexander Strauch
Wachkoma (Apallisches Syndrom)
Die Bezeichnung apallisches Syndrom wurde erstmals 1940 vom deutschen Psychiater und Nobelpreisträger Ernst Kretschmer (1888 – 1964) verwendet, als dieser die Symptome der Hirnschädigung bei einem Patienten folgendermaßen beschrieb: „Der Patient liegt wach da mit offenen Augen. Der Blick starrt gerade oder gleitet ohne Fixationspunkt verständnislos hin und her. Auch der Versuch, die Aufmerksamkeit hinzulenken, gelingt nicht oder höchstens spurweise, reflektorische Flucht- und Abwehrbewegungen können fehlen (…).“
In der medizinischen Praxis ist der Begriff „Wachkoma“ umstritten bzw. wird als ungenau bezeichnet, da er in sich widersprüchlich ist: Das Wort Koma stammt aus dem Griechischen und bedeutet soviel wie „tiefe Ohnmacht“, also völlige Bewusstlosigkeit. Die englische Bezeichnung „minimally conscious state“ (Zustand des minimal möglichen Bewusstseins) ist zutreffender. Denn viele Patienten mit dem Krankheitsbild eines apallischen Syndroms reagieren durchaus auf manche Reize ihrer Umwelt. Durch Messungen der Hirnströme mittels EEG (Elektroenzephalogramm, Aufzeichnung der Hirnströme) kann hierbei in einigen Fällen auch gesagt werden, ob es sich bei der Reaktion um reine Reflexe handelt oder ob der Patient äußere Reize in der Großhirnrinde, dem Zentrum des Bewusstseins und Denkens, verarbeitet.
Ursachen für eine solche schwere Hirnschädigung können sowohl äußere Gewalteinwirkung (Schädel-Hirn-Trauma) als auch ein zu lange bestehender Sauerstoffmangel als Folge eines Kreislaufstillstandes sein. Ferner können auch ein Schlaganfall, ein Hirntumor, eine Gehirnhautentzündung (Meningitis) oder neurodegenerative Erkrankungen wie Parkinson-Syndrom oder die Alzheimer-Krankheit im fortgeschrittenen Stadium zum apallischen Syndrom führen.
Für die Diagnose eines apallischen Syndroms und eine erste Verlaufsprognose ist eine Kombination verschiedener Untersuchungsverfahren erforderlich. Neben der klinischen Beobachtung des Patienten und der fortlaufenden Dokumentation seiner neurologischen Defektsymptome kommen die Hirnstrommessung (EEG) sowie die bildgebende Untersuchung der Hirnregion mittels Magnetresonanztomographie („Kernspin“) zur Anwendung. Es geht hierbei auch um die Abgrenzung des von der Symptomatik her ähnlich erscheinenden, so genannten Locked-In-Syndroms (Gefangensein-Syndrom): Hierbei bleibt das Bewusstsein des Betroffenen größtenteils erhalten. Er ist zumeist ebenso aufnahmefähig wie ein Gesunder, kann alles in seiner Umgebung hören und verstehen, ist jedoch sprech- und bewegungsunfähig und kann sich allenfalls durch verschiedenartige Augenbewegungen mitteilen.
Je länger der Status des apallischen Symptoms anhält, desto ungünstiger wird die Prognose hinsichtlich einer Besserung. Der weitere Verlauf ist ähnlich schwierig vorherzusehen wie die Diagnosestellung oft unsicher bleibt. Bei apallischem Syndrom nach Sauerstoffmangel wird allgemein nach 6 Monaten und beim posttraumatischen Syndrom nach 12 Monaten ohne merkliche Besserung des Zustandes davon ausgegangen, das die Schädigung dauerhaft (persistent) ist. Die international übliche Bezeichnung hier für ist PVS (Persistent Vegetative State). Der Betroffene bleibt dann zeitlebens ein Intensivpflegefall, mit entsprechend einschneidenden Folgen für die Angehörigen. Es empfiehlt sich für Jeden, beizeiten mittels einer hinterlegten Patientenverfügung zu definieren, wie in so einem Fall weiter vorgegangen werden soll. Wenn Sie weiterführende Informationen zu dieser komplexen Problematik suchen, lohnt etwa ein Besuch des Portals www.schaedel-hirnpatienten.de .
Die medizinische Literatur kennt indes auch Fälle, wo nach über zweijährigem Wachkoma-Zustand noch eine langsame Wiederkehr der Bewusstseinsfunktionen mit Wiederherstellung der Kommunikations- und Interaktionsfähigkeit stattfand. Wird eine beginnende Besserung (Remissionsphase) festgestellt, kommt eine Reihe von Therapieverfahren zur weiteren kontinuierlichen Wiederherstellung der geistigen und motorischen Funktionen zum Einsatz (Reizstimulation durch Ergo-, Logo-, Physiotherapie, Musiktherapie, neuropsychologische Behandlungen), wobei der erreichbare Grad der Wiederherstellung individuell sehr unterschiedlich ist.
Text: Alexander Strauch